La espasticidad postictus es una de las secuelas que más condiciona la vida tras un ictus: aumenta el tono muscular, dispara los reflejos, limita el movimiento y complica desde el aseo hasta la marcha. A su carga física y emocional se suma un impacto económico notable: tratar a un paciente con espasticidad cuesta varias veces más que tratar a uno sin esta complicación. Los recursos disponibles ayudan, pero con matices: la toxina botulínica puede perder eficacia con el tiempo, el baclofeno intratecal exige cirugía y vigilancia, los antiespásticos orales provocan somnolencia y fatiga, y la rehabilitación intensiva requiere una participación activa que no siempre es posible. En este contexto, interesa saber si la electroacupuntura (EA) tiene una base biológica sólida que justifique utilizarla como complemento.
El trabajo de You L et al., que comentamos es una revisión sistemática con metaanálisis de estudios preclínicos en modelos animales de espasticidad postictus. Su objetivo no es “probar eficacia clínica” en humanos, sino aportar plausibilidad biológica: mecanismos objetivos y medibles que expliquen por qué la EA podría ayudar. Para garantizar el rigor, se evaluó el riesgo de sesgo con herramientas específicas para investigación animal (SYRCLE’s RoB y CAMARADES), y se incluyeron 20 estudios que cumplieron criterios de calidad.
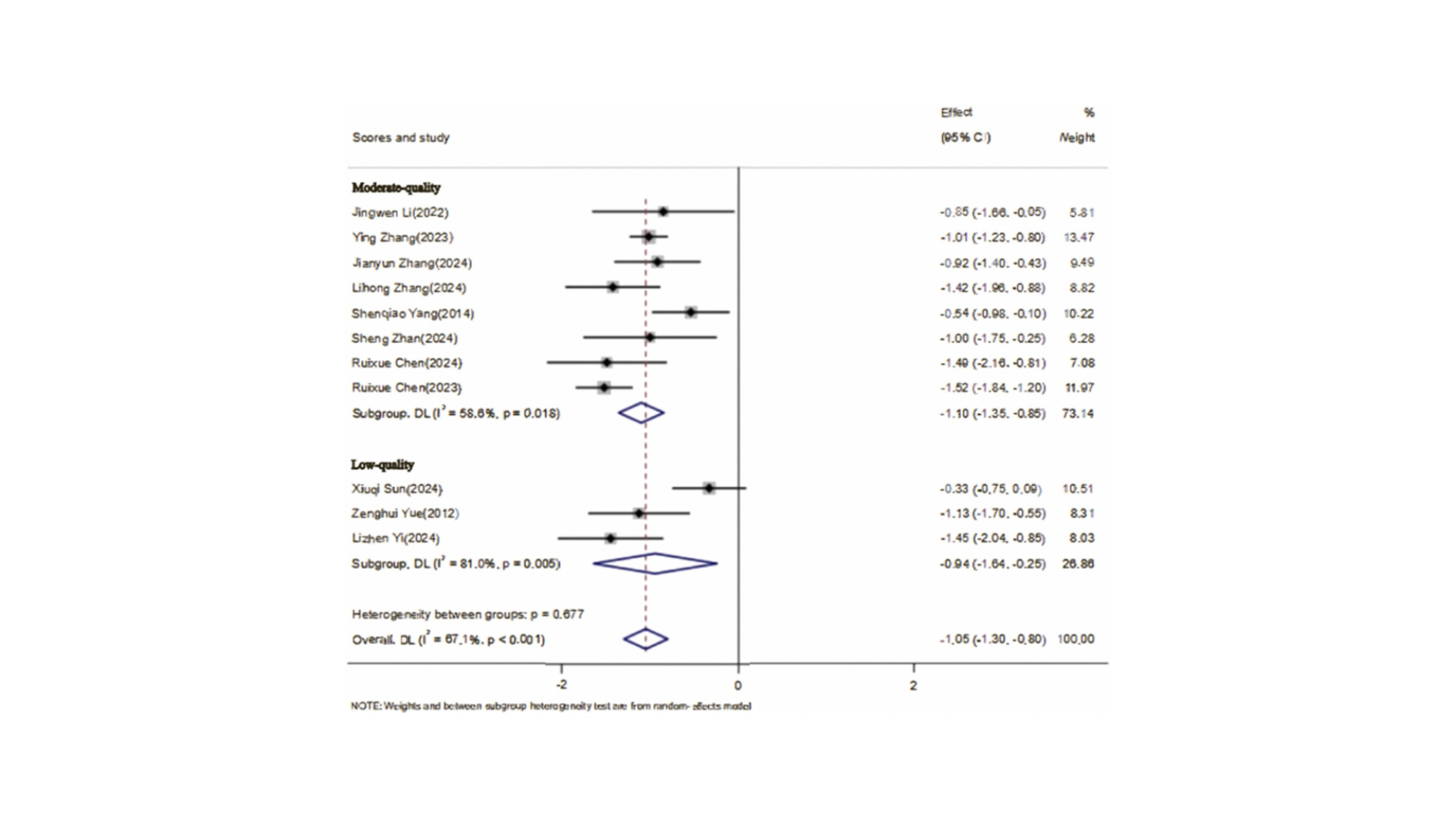
En términos de resultados, los animales tratados con EA mostraron menor déficit neurológico global. Once estudios que utilizaron la escala de Zea Longa informaron una mejora significativa (MD ≈ −1,05; p < 0,001), y dos estudios con la escala de Bederson replicaron esa dirección del efecto (MD ≈ −1,13; p < 0,001). En dos estudios que midieron la coordinación con la prueba de equilibrio en barra, la EA se asoció a una mejora funcional clara (MD ≈ −1,00; p < 0,001). En espasticidad, once estudios con la MAS señalaron una reducción significativa del tono (MD ≈ −1,06; p < 0,001) y seis estudios con medidas electrofisiológicas objetivas mostraron un efecto grande y consistente (SMD ≈ 3,84; p < 0,001). Estos hallazgos funcionales se acompañaron de cambios en el tejido: en tres estudios se observó reducción del edema cerebral (MD ≈ −3,79; p < 0,001) y en cuatro, menor volumen de infarto (MD ≈ −16,25; p < 0,001). La fortaleza del trabajo es que no se limita a describir mejorías, sino que propone un mecanismo de acción de la EA. Tras un ictus, se activan rutas inflamatorias como NF-κB y el inflamasoma NLRP3, aumentando citoquinas como IL-6 y TNF-α que elevan la excitabilidad neuronal y el tono muscular, además de favorecer la apoptosis. En los modelos analizados, la EA redujo IL-6 y TNF-α de manera significativa y moduló a la baja NF-κB/NLRP3, con menor activación de caspasa-3 y caspasa-9. En paralelo, la isquemia desencadena estrés oxidativo y peroxidación lipídica: sube el MDA (marcador de daño oxidativo) y cae el GSH (antioxidante clave). La EA disminuyó MDA y elevó GSH, y además reforzó el eje SLC7A11–GPX4, relevante para bloquear la ferroptosis, una forma de muerte celular vinculada al daño por lípidos. Se observaron aumentos de GPX4 (proteína y ARNm) y un incremento del ARNm de SLC7A11, coherente con una defensa antioxidante más eficaz. Otro pilar es el reequilibrio de neurotransmisores. La espasticidad postictus refleja un desequilibrio entre inhibición y excitación: déficit del inhibidor GABA y exceso del excitador glutamato, con sobreactivación de receptores NMDA. La EA elevó de forma consistente los niveles de GABA y redujo los de glutamato. A nivel enzimático, aumentó GAD67, clave en la síntesis de GABA, y disminuyó GABA-T, enzima que lo degrada, favoreciendo así un tono inhibitorio sostenido y conteniendo la hiperexcitabilidad espinal y supraspinal. Finalmente, el eje de plasticidad también se movió en dirección favorable: aumentos de BDNF y de su receptor TrkB (proteína y, en el caso de TrkB, también ARNm) apoyan la hipótesis de mayor neuroplasticidad y reorganización de circuitos motores. Una nota sobre la heterogeneidad, porque suele generar dudas: varios desenlaces presentaron I² elevado, algo esperable en preclínica por la diversidad de modelos y protocolos. Los autores ajustaron con modelos de efectos aleatorios y comprobaron la robustez de las conclusiones con análisis de sensibilidad. El resultado fue estable: la magnitud y la dirección de los efectos se mantuvieron, lo que da confianza en la fiabilidad del conjunto. ¿Qué significan los resultados de este trabajo para la práctica clínica? Que existe una base mecanística objetiva y sólida para plantear la EA como complemento potencial frente a la espasticidad postictus: menos inflamación y apoptosis, mejor defensa antioxidante y antiferróptica, reequilibrio GABA–glutamato y señales de plasticidad aumentadas. Referencia: You L, Hu M, Li J, Tan J, Guo F, Kong Y. The mechanism of electroacupuncture treatment for post-stroke spasticity: A systematic review and Meta-Analysis. Behav Brain Res. 2025 Oct 14:115873. doi: 10.1016/j.bbr.2025.115873. Epub ahead of print. PMID: 41101592.
 Fuente
Fuente Dr. Beltran Carrillo
Dr. Beltran Carrillo





